- À propos de nous
Actualités
Vous voulez être donneur?
- Procréation médicalement assistée
Prix et financement
Autres spécialités
- Quel est votre cas ?
- Contact
Une fausse couche est une expérience très triste et, si elle se répète, elle peut devenir traumatisante. Environ 15 % des grossesses se terminent par une fausse couche ou un avortement avant la neuvième semaine de grossesse..
Les avortements à répétition sont envisagés lorsque deux ou plusieurs grossesses non évolutives surviennent. Dans ces cas-là, chaque fausse couche augmente la possibilité de récidive lors de grossesses ultérieures, car elle indique l’existence d’une cause commune.
Les anomalies chromosomiques de l’embryon sont la cause la plus fréquente des fausses couches à répétition : elles sont à l’origine de 50 à 60 % des cas. Ce pourcentage augmente avec l’âge de la femme. Ces anomalies peuvent apparaître lors de la formation de l’embryon et être héritées du père ou de la mère.
Environ 4 % des couples victimes de fausses couches à répétition présentent une anomalie chromosomique dans le caryotype de l’un des parents. Le caryotype est analysé par une prise de sang. C’est la représentation des chromosomes d’une personne classés selon leur morphologie et leur taille. Chaque cellule possède 46 chromosomes, 23 paires héritées de la mère et 23 du père.
Les anomalies chromosomiques affectent généralement la structure du caryotype : il manque un morceau ou il y a un morceau en trop. Chez le parent porteur, l’altération est équilibrée, mais elle peut être transmise de manière déséquilibrée.
La grande majorité des avortements sont dus à des modifications du nombre de chromosomes dans l’embryon, car le sperme et/ou l’ovule ne possèdent pas l’ensemble de chromosomes approprié. Selon des études réalisées à l’Institut Marquès, dans la meilleure des situations, c’est-à-dire les embryons issus de donneuses d’ovocytes et de donneuses de sperme, près de la moitié présentent des anomalies chromosomiques. Cela semble beaucoup, mais la reproduction humaine est inefficace.
Le pourcentage d’embryons anormaux augmente avec l’âge de la femme, 78 % des embryons des patientes âgées de 40 ans étant altérés.
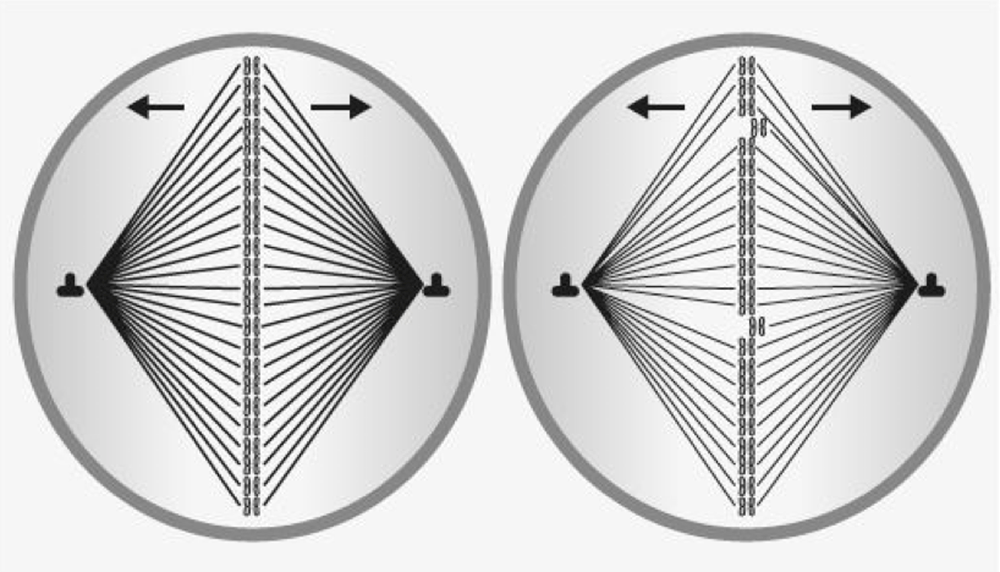
Dans le noyau des ovules, après l’ovulation, les 46 chromosomes se placent face à face pour se séparer. Les filaments qui les rejoignent sont libérés et il reste 23 chromosomes. À mesure que la femme vieillit, le passage du temps provoque des altérations de ce processus (chez les jeunes femmes, les bâtonnets qui les séparent effectivement sont résistants. Avec l’âge, ils s’affaiblissent et peuvent se briser comme les filaments d’une ampoule). Par conséquent, il peut rester des chromosomes supplémentaires (s’il y en a 21, cela entraînera le syndrome de Down) ou en nombre insuffisant, provoquant des échecs de fécondation ou des embryons présentant des altérations génétiques qui seront pour la plupart des avortements précoces.
Le risque d’avortement pour une femme de 35 ans est de 20 %, à 40 ans il est de 40 % et à 45 ans il est de 80 %. Mais l’âge ovarien n’est pas toujours le même que l’âge chronologique.
Pour connaître le risque d’avoir un nouvel avortement, il faut étudier la réserve ovarienne de la patiente en faisant une analyse hormonale anti-Müllérienne (calculez votre âge ovarien dans ce lien). Pour exclure que cela soit dû à des anomalies dans la composition chromosomique du sperme, une étude du sperme appelée FISH peut également être recommandée. L’étude de la méiose et des études de fragmentation de l’ADN double brin peuvent également être recommandées.
Le traitement indiqué en cas d’avortements récurrents causés par des altérations génétiques est la Fécondation In Vitro avec Analyse Génétique des Embryons (PGT). De cette manière, seuls les embryons chromosomiquement sains sont transférés dans l’utérus de la mère.
Lors d’une fausse couche, nous pouvons déjà déterminer une éventuelle cause génétique avec un simple test sanguin.
La cause la plus fréquente d’avortement est l’altération des chromosomes de l’embryon. Une prise de sang de la patiente permet actuellement de connaître le caryotype de l’embryon non évolutif en 4 jours environ.
Dès l’implantation, on retrouve l’ADN embryonnaire chez la mère, l’analyse peut donc être réalisée sur n’importe quel avortement, même avec seulement une semaine de retard.
C’est un grand progrès car lorsque cette étude est réalisée sur des restes avortés, par curetage ou par biopsie du chorion, il y a de nombreux échecs dans l’obtention du résultat et, en outre, l’échantillon peut avoir été contaminé par l’ADN de la mère. .
À l’Institut Marquès, nous prélevons l’échantillon de sang dans notre propre clinique pour réaliser l’analyse « PregnancyLoss ». Le coût total est de 480 euros.


La thrombophilie héréditaire est une prédisposition génétique à augmenter la coagulation sanguine. Cela est dû à des variantes génétiques des protéines impliquées dans la coagulation. En conséquence, des thrombus peuvent se former. Ils surviennent généralement dans les jambes mais peuvent se détacher et provoquer une thromboembolie pulmonaire.
La grossesse induit un état d’hypercoagulabilité chez toutes les femmes ; c’est un changement physiologique pour éviter les hémorragies lors de l’accouchement. Chez les patients atteints de thrombophilie, une thrombose peut apparaître dans le placenta, réduisant la vascularisation du fœtus et provoquant des avortements. Ils présentent également un risque plus élevé de thromboembolie post-partum.
Le test standard pour diagnostiquer la thrombophilie génétique est un test sanguin pour la protéine C, la protéine S, l’antithrombine III et le facteur V de Leyden. Mais cette analyse ne parvient à identifier que 20 % des cas. L’étude du Profil Génétique de la Thrombophilie permet de détecter 85% des patients atteints de cette maladie.
Le traitement des patients atteints de thrombophilie génétique est effectué sur une base individualisée avec de l’héparine de bas poids moléculaire.
Malformations utérines congénitales dans lesquelles l’utérus est très petit et/ou déformé et d’autres dans lesquelles il existe une cloison fibreuse qui divise la cavité utérine en deux « cloison utérine ». L’incidence de ces malformations est de 0,3 % dans la population générale et d’environ 4 % chez les patientes ayant subi un avortement.
Les altérations utérines sont diagnostiquées par :
Les troubles de la thyroïde et le diabète, s’ils sont médicalement contrôlés, ne sont PAS une cause d’avortements. Il n’existe également aucune preuve scientifique de l’existence d’une hyperprolactinémie ou d’une insuffisance du corps jaune.
Au cours des 10 dernières années, nous avons fait d’énormes progrès dans le diagnostic des avortements récurrents d’origine embryonnaire. Le grand défi est d’améliorer le diagnostic des avortements récurrents d’origine maternelle. Cela continue d’être notre cheval de bataille en recherche. Le fait que dans de nombreux cas la cause soit inconnue et que la prochaine grossesse se déroule normalement a donné lieu à tous types de diagnostics et de traitements.
À l’Institut Marquès, nous disposons de tous les traitements de Procréation Assistée dans lesquels nous utilisons la technologie la plus avancée.
Nous finançons tous vos traitements de Procréation Assistée. Calculez-le vous-même avec notre nouveau calculateur de financement.
Nous sommes différents des autres centres : des professionnels agités qui recherchent constamment l’amélioration et l’excellence.
Rellena el formulario y nos pondremos en contacto contigo para organizar una visita con un especialista en Reproducción Asistida.


Institut Marquès, clínica LGTBI Friendly